GMP (Good Manufacturing Practice, 우수 의약품 제조·관리 기준)
GMP란 우수한 의약품을 제조하기 위하여 공장에서 원료의 구입부터 제조, 출하 등에 이르는 모든 과정에 필요한 관리기준을 규정한 것이다. 美 FDA가 1963년 GMP를 제정·공표하면서 WHO(세계보건기구)와 각국에서 GMP를 도입하기 시작했다. 우리나라는 1977년에 GMP를 도입했으며, 1995년에 의무화 했다.
아래의 그림은 변경부탁드립니다. 다른업체에서 복사해온것이라 사용할 수 없습니다.
각 국가의 규제기관 및 국제기구는 자체적으로 GMP 가이드라인을 규정하고 있으며 이를 따르지 않을 시 의약품 등록에 불이익을 준다. GMP 중 가장 높은 수준으로 평가받는 cGMP는 ‘current good manufacturing practice’로, 美 FDA가 현대적이고 혁신적인 품질관리 시스템과 위험관리 접근방식을 도입하자는 취지로 2002년 만들었다.
아래의 그림은 변경부탁드립니다. 다른업체에서 복사해온것이라 사용할 수 없습니다.
EU GMP나 WHO GMP도 마찬가지다. EU GMP는 유럽 식약처라 할 수 있는 유럽의약품청(EMA)에서 정한 가이드라인 이며, WHO GMP는 WHO주관 입찰을 통해 수출하는 백신이나 생물학적 제제에 대한 제조·관리에 대한 기준이다.
이 밖에도, 우리나라가 2014년에 정식회원이 된 의약품 상호실사협력기구 PIC/S(Pharmaceutical Inspection Cooperation Scheme) 역시 GMP 가이드라인을 갖고 있다. PIC/S 회원국들은 의약품 실사정보를 공유해 의약품 허가 등록 시 필요한 GMP 실사를 면제 또는 간소화 할 수 있다.
의료기기 및 체외진단 의료기기 적용범위
- – 의료기기 제조·수입허가 또는 제조·수입인증을 받거나 제조·수입신고를하고자 하는 자
- – 임상시험용 의료기기를 제조 또는 수입하고자 하는 자
- – 적합성 인정 및 정기심사를 받고자 하는 의료기기 제조업자 또는 수입업자
- ※ 의료기기 제조 및 품질관리기준
- ※ 체외진단 의료기기 제조 및 품질관리기준
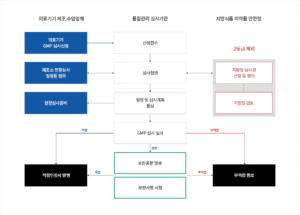
의료기기 GMP 인정업무 처리절차
http://www.ktr.or.kr/certification/kc/contentsid/445/index.do 도면은 여기가 가지고 왔습니다. 새로 만들어주세요
문의하기
문의폼 하나를 넣어주세요